ONL Therapeutics推进Xelafaslatide治疗地图样萎缩的2期临床试验
解锁更多功能
登录后即可使用AI智能分析、深度投研报告等高级功能
关于我们:Ginlix AI 是由真实数据驱动的 AI 投资助手,将先进的人工智能与专业金融数据库相结合,提供可验证的、基于事实的答案。请使用下方的聊天框提出任何金融问题。
相关个股
本分析基于2025年10月28日发布的ONL Therapeutics公告 [1],内容涉及评估xelafaslatide治疗地图样萎缩的全球2期GALAXY试验首例患者随机入组事宜。
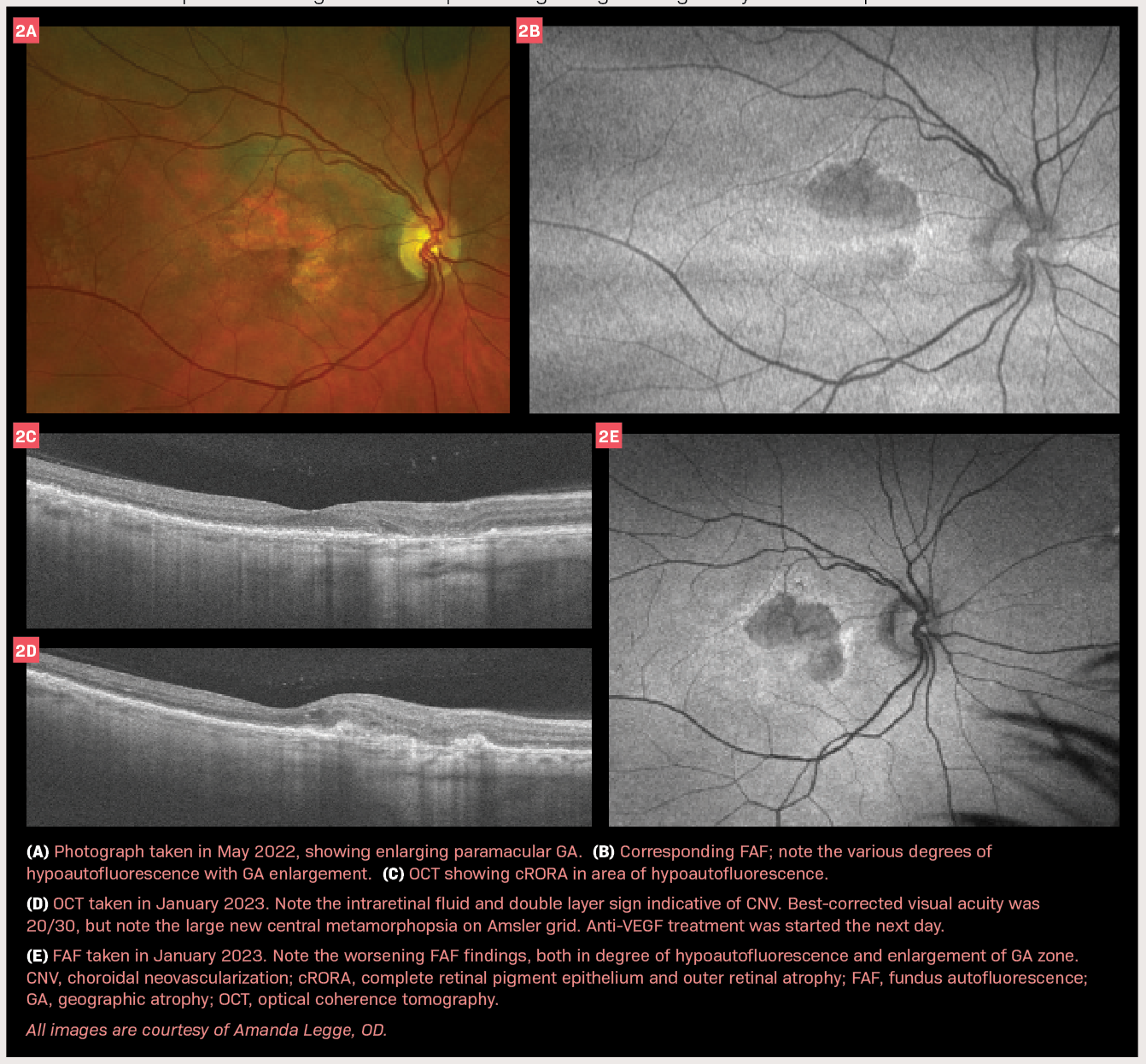
ONL Therapeutics在其xelafaslatide(ONL1204)治疗干性年龄相关性黄斑变性相关地图样萎缩(GA)的2期GALAXY试验中完成首例患者随机入组,达成了重要的临床开发里程碑[1]。此次进展是在世界卫生组织和美国采用名称委员会近期批准“xelafaslatide”作为ONL1204眼用溶液的官方通用名之后实现的[1]。
该疗法通过Fas受体抑制机制代表了同类首创的方法,与目前FDA批准的针对补体蛋白的GA治疗方法存在根本差异[1]。Xelafaslatide是一种小型肽,旨在通过在受体水平阻断Fas激活来保护视网膜细胞免于凋亡,从而防止下游死亡通路和炎症级联反应[3]。这种神经保护策略与现有补体抑制剂以炎症为重点的方法形成对比[2]。
2期GALAXY试验正在评估两种给药频率(每12周和每24周一次),剂量水平为100µg和200µg,治疗期为72周[2]。与目前批准的每25-60天需给药一次的疗法相比,这种延长的给药方案可能大幅降低治疗负担[4]。此前的1b期结果表明,xelafaslatide总体上安全且耐受性良好,疗效信号显示6个月后与未治疗眼相比,GA病变生长减缓[2]。
Xelafaslatide通过其创新的Fas抑制机制和延长的给药间隔,代表了GA治疗中一个潜在的重大进步。该疗法针对全球约500万受GA影响的个体,其中包括美国的150万[4]。GA约占英国法定失明病例的25%和北美的20%,凸显了巨大的未满足医疗需求[4]。
2期GALAXY试验标志着一个关键的开发里程碑,可能使ONL Therapeutics在快速增长的GA市场中成为有意义的竞争者。该产品的差异化方法提供了潜在优势,包括更低的给药频率(每3-6个月一次,而当前疗法为每月或每两个月一次)和新颖的神经保护机制[1]。然而,商业成功将取决于在剩余的临床开发中证明稳健的临床疗效并保持有利的安全性特征。
随着GA市场预计到2029年将达到35亿美元[5],如果xelafaslatide能够成功通过监管途径并在日益拥挤的治疗领域建立竞争差异化,它将具有显著的商业潜力。该疗法的成功还将验证Fas抑制平台在更广泛的视网膜疾病应用中的价值,可能为ONL Therapeutics的管线开发创造额外的价值机会。
数据基于历史,不代表未来趋势;仅供投资者参考,不构成投资建议
关于我们:Ginlix AI 是由真实数据驱动的 AI 投资助手,将先进的人工智能与专业金融数据库相结合,提供可验证的、基于事实的答案。请使用下方的聊天框提出任何金融问题。